使用Fluigent的 FlowEZ評估人類血腦屏障 (BBB)
3D blood vessel-on-a-chip(VoC)模型對於捕捉動態微環境因素(例如壁面剪切應力(WSS)和周向應變(CS))下血管壁的生物複雜性至關重要。然而,由於單一3D-VoC的直徑存在差異,控制這些參數頗具挑戰性,導致重現性差,且每次只能進行一個通道的通量檢測。
麻省理工學院 (MIT) 的 Roger D. Kamm 團隊開發了一種微流體 BBB 通透性模型 ,該模型連接到Fluigent的 Flow-EZ 壓力控製器,能使用一組控制參數同時灌注多達 12 個 3D-VoC。
血管微流體晶片技術
血管對於在全身輸送必需營養物質和清除代謝廢物至關重要,在維持器官正常功能方面發揮關鍵作用。然而,病變的血管可能導致各種嚴重疾病,例如動脈硬化、動脈瘤和敗血症。為了在體外精確複製血管複雜的微環境,研究人員轉向微流體技術,該技術能夠創建「血管微流體晶片」(VoC)模型。這些模型能夠精確地重建血管功能,為了解血管生物學和疾病機制提供寶貴的見解。
內皮細胞和血流動力學的作用
在血管內,內皮細胞 (EC) 構成重要的內壁,與週細胞和平滑肌細胞(稱為壁細胞)相互作用,調節血管功能。壁細胞與 EC 細胞的相互作用對於維持血流動力學以及確保血液與周圍組織之間有效的營養交換至關重要。此外,EC 在調節發炎反應中發揮關鍵作用,從而影響免疫細胞運輸和組織穩態。血流動力學因素,包括壁面剪切應力 (WSS) 和周向應變 (CS),進一步塑造了 EC 的表型和功能。這些因素在不同大小和血管「樹」內不同位置的血管中存在差異,對 EC 的行為和血管生理產生重大影響。
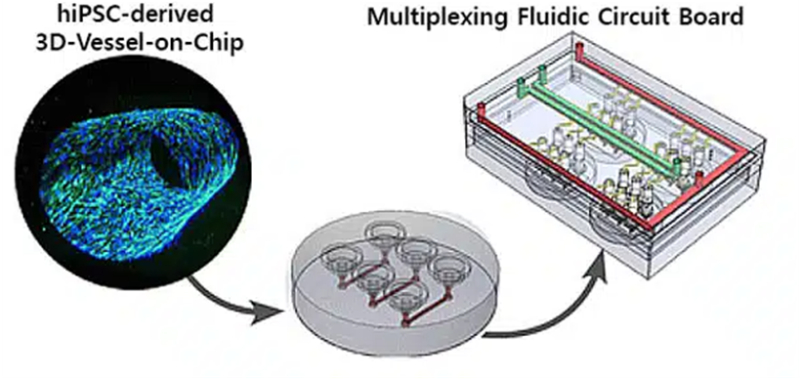
為了在體外複製血管的複雜結構和功能,研究人員開發了創新的微流體方法來建立3D血管微流體晶片(VoC)模型。這些模型整合了多種細胞類型、細胞外基質成分和血流動力學,從而緊密模擬血管的生理微環境。儘管取得了顯著進展,但在用於維持血管內皮細胞重複實驗中血流動力學條件一致的灌注系統方面仍存在挑戰。流體迴路等多通道循環策略能夠同時灌注多個血管微流體晶片,同時確保穩定的流體動力學,從而提供了有前景的解決方案。透過應對這些挑戰,研究人員可以提高血管微流體晶片模型的可靠性和可重複性,從而加深我們對血管生物學和疾病病理學的理解。
使用 FlowEZ 進行 VoC 灌注
Roger D. Kamm團隊設計了一種流體迴路,其中多個晶片血管可同時連接到一個並聯流體迴路中(圖2),以實現3D-VoC裝置的多路復用灌注。 流體迴路具有一個主供料通道(綠色通道),該通道分支成單獨的VoC通道(黃色通道),並有一個廢液通道(紅色通道)將流體引導至另一個儲液器(圖2c)。供料通道和廢液通道中的壓力感測器透過客製化軟體調節流量。此流體迴路最多可容納四個VoC裝置,每個裝置有三個微流體通道(圖2b)。
創造血管微流體晶片
使用移液管吸頭製作膠原蛋白支架,用於圖案化(圖 2aii)。以復溶緩衝液和高濃度膠原蛋白 I 製備膠原蛋白 I 水凝膠。將混合物注入接收吸頭,直到彎月面到達驅動吸頭出口。加入 PBS 啟動圖案化,然後進行孵育和凝膠化。將內皮生長培養基移入接收吸頭,並進一步培養裝置。在細胞接種前,取出吸頭,並注入 HiPSC-EC。注射後,將微流控裝置置於慢速旋轉器(1 RPM)上,在 37 °C 下旋轉 1 至 2 小時,直到所有細胞附著並完全覆蓋膠原蛋白支架。然後將樣品與每日更新的培養基一起孵育。
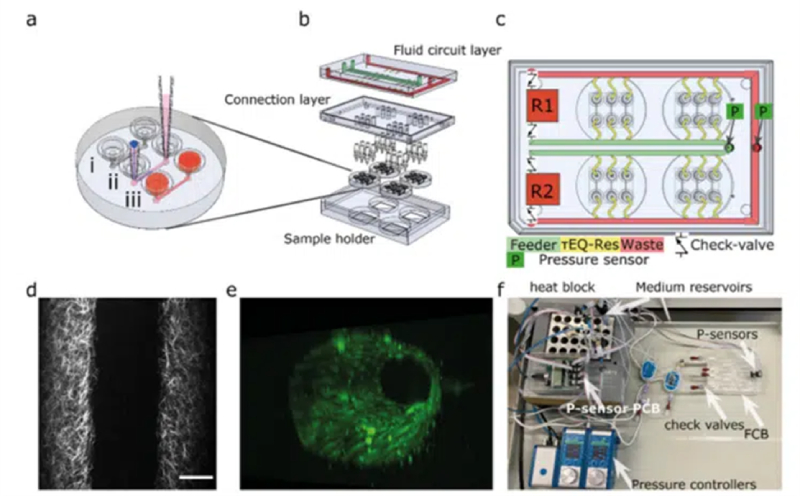
使用雙光子二次諧波發生 (2P-SHG) 對支架進行成像(圖 2d)。
圖 2e 顯示了本研究中使用的晶片血管的 3D 重建。
使用Flow EZ 345 製造流體迴路
流體迴路的測試採用了板外培養基儲液器、Fluigent 的單向閥和流量感測器,以減少製造步驟(圖 2f)。測試中使用 15 mL Falcon 管作為儲液器,配備 4 端口壓力蓋,並連接低阻力 PTFE 管。對於長期細胞培養,則採用了單一流量感測器的替代迴路。
安裝了壓力感測器以測量流體迴路和儲液器液位之間的壓力差。這些感測器透過 USB 連接到微控制器和電腦。一個基於 Python 的客製化 PID 控制器管理 Fluigent 的壓力控制器 (FlowEZ)。
使用兩個連接到培養基儲液器的 345 mbar 氣動壓力控制器來控制壓力,以模擬人體生理血壓的全範圍。
部份成果
為了證明流體迴路在生物學研究中的實用性,作者研究了 3D 血管晶片對血液動力學力量的反應。
評估內皮細胞對周向應變的反應
首先,他們以膠原支架作為對照,研究了內皮細胞對無血流腔內壓力誘導的周向應變 (CS) 的反應。
使用直立式活體顯微鏡,以 2P-SHG 對膠原支架進行成像。
使用寬視野螢光顯微鏡,對接種了 TUBA1B-mEGFP-hiPSC-ECs 細胞的 3D-VoC 進行成像,在不同管腔壓力點(從 P = 0 到 P = 345 mbar,增量為 25 mbar)下進行成像。
影像顯示裸露支架和接種細胞的支架均對稱擴張(圖 3a、b)。與僅有支架的情況相比,內皮細胞單層的存在顯著降低了應變。圖 3c 顯示了無細胞(膠原支架,n = 3)和有細胞(3D-VoC,n = 6)的管腔應變曲線。
接下來,他們使用轉盤共聚焦顯微鏡更詳細地分析了周向應變條件下的hiPSC-EC單層細胞。 VE-鈣粘蛋白連接在高達100 mbar的壓力下仍保持完整,但在更高壓力下出現過度拉伸。在150 mbar的管腔壓力(應變約為2%)下,黏附連接呈現鋸齒狀圖案,顯示EC-單層細胞過度拉伸,細胞間連接部分打開(圖3d,e)。儘管如此,單層細胞在高達345 mbar的壓力下仍保持完整,細胞核沿著管腔軸線排列,沒有連續流動,這意味著細胞單層細胞過度拉伸但未破裂。
評估內皮細胞對壁面切應力的反應
他們也研究了血管晶片模型中細胞壁面剪應力 (WSS) 的反應。將管腔在靜態條件下保持 48 小時以促進細胞附著,然後灌注 24 小時。將 48 小時靜態和 24 小時灌注實驗與 72 小時靜態實驗進行了比較。
在沒有血流的情況下,F-肌動蛋白主要位於皮質邊緣,整體強度較低(圖 4a)。另一方面,暴露於 0.3 Pa WSS 24 小時的細胞顯示出肌動蛋白應力纖維形成,這表明內皮細胞能夠對施加的血流做出反應(圖 4b)。
結論
總體而言,結果證明了該灌注平台能夠同時對多達12個晶片上的血管施加雙模態機械刺激—壁面剪應力 (WSS) 和周向應變 (CS)。流體迴路設計最大限度地減少了由於不同3D-VoC直徑導致的壁面剪應力變化,無需單獨控制樣品,並提高了通量。這是第一個用於3D-VoC的多重化、受控灌注系統。
透過將此系統與可擴展的3D-VoC生成方法結合,他們增加了每個實驗的重複次數。流體迴路可以使用兩個壓力控制器獨立控制壁面剪應力和內部壓力,同時循環細胞培養基。他們發現,hiPSC-EC在壁面剪應力和周向應變刺激下表現出不同的形態變化,凸顯了體外控制這兩種刺激的必要性。
未來的研究可能包括對hiPSC-EC在不同條件下對壁面剪應力、周向應變及其組合刺激的反應進行詳細的結構和功能分析。流體迴路的靈活性有望推動器官晶片技術的發展,提供更強大的預測能力。這種簡單的設計可以與先進的概念結合,打造更有效率、更便利的灌注平台。


