應用實例-使用3D微流體進行奈米微脂體生產
前言
儘管近年來各種疾病的診斷和治療已取得了長足的進步,但仍存在某些限制有待解決,例如敏感度或特異性低、藥物毒性和嚴重的副作用[1]。癌症是使用局部治療藥物疾病的最好例子之一,因為這類化合物有效但有毒的作用機制可能導致有效的反應或副作用。如今,大多數藥物配方劑型都無法定位到感興趣的特定位置,而以奈米顆粒為基礎的藥物遞送平台已經出現,成為克服這些限制的合適工具[2]。奈米顆粒,例如微脂體,具有事實證明在保存治療材料和延長藥物的壽命期限方面具有優勢[3]。
微脂體是在1960年代發現的。這些空心奈米顆粒是磷脂囊泡由至少一個脂質雙層構成 (圖1)。該雙層通常由磷脂具有親水性的磷酸酯頭和疏水性的兩個脂肪酸鏈所組成。這種結構特徵促進了微脂體的應用:作為人造細胞膜、藥物遞送系統的載體、用於食品成分和分析工具[4] [5] [6] [7] [8]。
在COVID-19大流行期間,首批達到臨床試驗的疫苗是以病毒的載體和核酸技術為基礎。最有前途的候選疫苗之一是以核苷修飾的mRNA被包裹在微脂體奈米顆粒中[9]。這也確認了目前和將來的藥物遞送應用對微脂體奈米顆粒的需求。這些接近球形的脂質囊泡的大小範圍可以從幾奈米到幾微米。但是,用於醫療用途的微脂體通常在50至450 nm之間[1]。
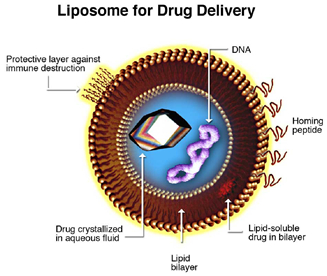
圖1.奈米微脂體的例子,其由磷脂質、靶向胜肽、藥物及核酸組成
1.微流控方法可高度控制微脂體的生產
尺寸大小和大小分佈是決定藥物臨床成功的基本屬性,研究人員觀察到奈米載體大小會影響微脂體的積聚以及靶向腫瘤部位的穿透效率[1]。過去已經採用了不同的方法用於微脂體的生產:批次生產方法被廣泛用於微脂體的生產,例如超聲處理技術、水合方法 [10] 或擠出方法[11]。這些技術通常顯示較大的尺寸分佈而且封裝效率也不一致[10],並且控制性和重複性是不夠的。
近來,隨著微流體的發展已經改善了生產微脂體的方法。使用直徑不同的微米通道(通常最大為500μm),流體流導致層流。在典型的微微脂體生產系統中,含有磷脂的有機相(乙醇,異丙醇等)與水相(蒸餾水,PBS等)平行層流,這使得有機相與水相介面產生擴散混合和局部稀釋。有機相濃度降低直至達到脂質的溶解度極限,而觸發了自組裝磷脂形成隨後收集下來的微脂體。在微流體條件下,它是可以精確調整參數(例如水和有機物的流速)以實現不同的微脂體的大小和封裝效率。這些方法顯示對最終產品的物理性能方面,特別是在微脂體尺寸和大小分佈方面具有更高的控制力。
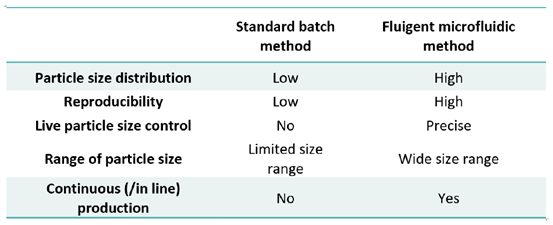
表1.比較標準批次生產及Fluigent微流體生產微脂體方法間的差異
2.玻璃毛細管裝置改善顆粒大小分佈
許多微流體系統都利用微流體流體動態聚焦(MHF)技術合成微脂體。在標準設計(2D-MHF)中,有機相與脂質在矩形通道的中心流動,水性緩衝液在矩形通道的兩側流動(圖2A)。但是,由於2D-MHF晶片依靠於平面流聚焦,因此表面體積比較差,限制了微脂體在兩個脂質/水界面的合成。在晶片的上方和下方也遇到問題,這些設計通常根據所使用的流體,需要特定的表面塗層。為了克服這些限制,玻璃毛細管設備已經開發出來,可以產生流體動態聚焦的3D流,其中水相完全包圍脂質相(圖2B)。這個結果實現了徑向對稱混合流體輸入,促進了高度均勻的奈米級微脂體的生產。與2D-MHF相比,此設計顯示出更窄的尺寸分佈。這些設備通常會不需要任何表面塗層,因為脂質相與在其中形成微脂體的毛細管管壁之間沒有接觸。
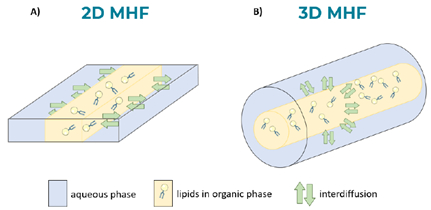
圖2.兩種生產微脂體的微流體設計。
(A) 二維微流體流體動態聚焦(MHF)技術,顯示在lipid與水相的兩界面;
(B) 三維微流體流體動態聚焦(MHF)技術,顯示介面面積更大。
在本篇應用實例中,我們展示了使用Raydrop™(Raydrop™是Secoya Technologies的註冊商標):市售具有以玻璃毛細管設計3D軸對稱幾何形狀的微流體裝置。
材料及方法

圖3.微脂體生產之微流體組合配置
1.材料
(1)微流體系統
- 壓力控制器:兩台2000mbar Flow EZ,可直接串聯擴充使用。具備旋鈕按鍵及面板,毋須電腦單機即可操控,也可連接電腦進行自動化程控 (需要LINK module)。
- 流量計:Flow Unit是一個流量感測器,可以實時測量流量。藉由將Flow Unit與Flow EZ結合使用,可以從壓力控制到流量控制,允許長時間產生單分散的液滴。使用兩個Flow Unit M監控分散相和連續相的流速。
- 切換閥:2-Switch 三孔雙向切換閥用來切換乙醇及含脂質的乙醇,控制進廢液管或收集管等。藉由實驗中加入清洗步驟、注入清洗液等,提升了生產力。
- 微流體晶片:Raydrop™是一種通用的微流體晶片,可用於高精度流體混合。它以兩個玻璃毛細管的對齊方式浸入含有連續相的加壓室中,分散相通過3D列印的噴嘴離開毛細管,噴嘴位於第二毛細管,被連續相包圍。這種非嵌入式軸對稱流聚焦也叫做共流聚焦,允許生成流體動態聚焦的3D流。優點在於其幾何設計可防止可能會出現在其他微流體晶片中的濕潤性問題,並且可拆卸清洗,解決一般PDMS晶片堵塞報廢的問題。這允許以任何類型的流體生成高度單分散的奈米顆粒。
(2)試劑 (皆以0.2μm濾膜過濾過)
- 分散相:Absolute ethanol (LiChrosolv Supelco, Merck, Germany), Lipids 10 mg/mL (Phospholipon 90G, Lipoid, Switzerland) 和Dimethyldioctadecylammonium (DDAB) 2.5 mg/mL (from Merck,Germany)
- 連續相:Phosphate-buffered saline (PBS) (pH 7.2)
- 清洗液:Absolute ethanol (LiChrosolv Supelco, Merck, Germany)
2.微脂體生產及尺寸分析
如前所述,脂質在乙醇溶液中的流(分散相)被水相(連續相)包圍在玻璃毛細管中。含有脂質的乙醇溶液擴散到水溶液中(同時水會擴散到酒精中),直到酒精濃度降低達到脂質的溶解度極限。結果,這種擴散觸發了微脂體被稱為“自組裝”的機制,其中脂質組裝成更多在能量上有利的結構,在生成微脂體中,通常有兩個參數用於調整聚焦流的大小:水相與乙醇相之間的流速比(FRR)和總流速(TFR)。 Jahn等人首先證明產生的微脂體的平均大小與FRR成反比。反之,當改變TFR時對微脂體大小影響不大[14] [15]。在其他研究中也證實了這些結果,這些參數將會在此應用實例中探討。
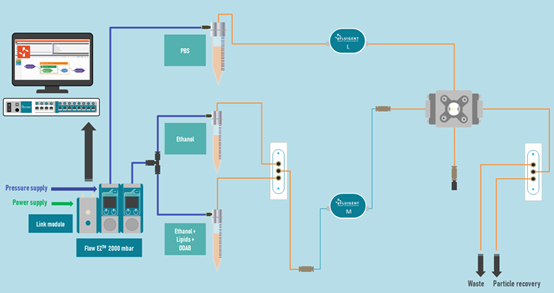
圖4.微流體生產微脂體的圖解
微脂體生產系統如圖4所示。兩個15 mL的容器內裝乙醇、含脂質的乙醇,連接到2-SWITCH,再連接到通過1/16英寸PEEK管(內分散相)的微流體晶片。1個裝有PBS緩衝液的50 mL樣品管連接到晶片的第二個入口(外連續相),管線通過流量計以進行流量監控。出口管連接到第二個2-SWITCH切換閥可以在廢液管和顆粒收集之間切換。
(1)微脂體生成
- 通過2-SWITCH選擇含有無水乙醇的15 mL樣品管。乙醇是作為分散相注入,同時PBS緩衝液(連續相)流開始充滿系統並產生乙醇和PBS緩衝液的共流,這時應該施加兩個樣品管相同的壓力。
- 一旦達到穩定的共流,就可以輕鬆地將含脂質的乙醇溶液通過將2-SWITCH切換到第二位置(脂質/乙醇)注入。
- 微脂體應於1分鐘內開始生產 (液體轉換所需的時間)
- 然後可以調節壓力和/或流速以達到所需的TFR和FRR (圖5)以控制相關的微脂體大小。

圖5.含脂質的乙醇被PBS緩衝液圍繞的液流
(2)微脂體尺寸分析
生成後,使用動態光散射技術(DLS)進行微脂體大小分析。對於每個樣本進行3次測量,計算尺寸中值及其相關多分散指數(PDI, 分佈的指標)。圖6顯示了微脂體的尺寸中值及其對應的多分散指數是FRR的函數。TFR保持恆定約100μL/ min。我們觀察到在這些條件下生成的微脂體的直徑範圍為〜30 nm至〜155 nm。此外我們也觀察到,當FRR增加時,微脂體直徑減小:當FRR=4可獲得87 nm直徑的微脂體,而當FRR=9可獲得29 nm直徑的微脂體,這結果與使用微流體方法的文獻[14] [15]結果一致,同樣歸因於中心液流含脂質乙醇的聚焦程度增加。這個控制能力是使用標準批次生產方法達不到的,可控的尺寸範圍也較其他一般微流體系統更廣[13]。依照圖6結果,PDI範圍從0.07到0.15。
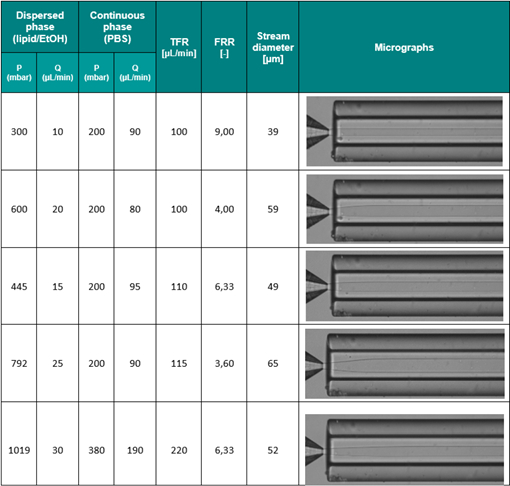
最後,TFR對微脂體的尺寸影響可參考表2。當FRR被設定為定值6.33、變動TFR參數從110 μL/min 至 220 μL/min,微脂體的尺寸從50nm變動至59nm。這個結果也和先前的研究[14] [15]一致。
高度單分散微脂體的生成,其大小範圍約為30 nm至150 nm,證實了Raydrop™在微脂體合成方面的巨大潛力。值得注意的是,通過使用其他FRR參數值可以達到更寬的微值體大小範圍。
%E6%98%AFTFR%E7%9A%84%E5%87%BD%E6%95%B8%E3%80%82.jpg)
表2.微脂體直徑與其多分散指數(PDI)是TFR的函數。FRR保持大約6.33的定值。
%E6%98%AF%E6%B5%81%E9%80%9F%E6%AF%94(FRR)%E7%9A%84%E5%87%BD%E6%95%B8.jpg)
圖6.微脂體平均直徑大小與多分散指數(PDI)是流速比(FRR)的函數
結論
奈米微脂體已被證明在溶解性治療物質方面是有利的。大規模用於微脂體生產的批量方法缺乏控制微脂體的形態、大小和分佈。微流體生產系統允許高度單分散奈米微脂體顆粒的生產,我們已經證明使用氣動式壓力控制微流體系統生產微脂體以及標準配置的Raydrop™微流體晶片,產生的微脂體範圍為30至150 nm,尺寸大小可以通過調整控制設備流量輸入參數尤其是流量比(FRR)達成,多分散指數(PDI)的範圍是從0.07到0.15。此系統允許依照食品添加、藥物遞送系統等不同應用所需的封裝材料、奈米等級尺寸、球形等需求製作微脂體,是一個可依需求製作生產單分散奈米微脂體的完整、經濟高效、可商業取得的平台,現在即刻擁有。


