應用實例- 血管模型:為何選擇氣動式壓力液體控制器而非有脈衝的蠕動式幫浦
前言
微流體細胞培養相較於培養於燒瓶、培養皿、微量樣品盤有明顯的優勢,提供了可以準確重現細胞培養環境及生化反應分析的可能性,由於反應體積的減少也降低了花費這點也是主要的優勢之一。微流體對細胞生物學的主要貢獻之一在於細胞灌流培養的能力,第一個實驗在血管內皮細胞上,微流體培養相較於靜態培養顯示了空前的結果,內皮細胞在模擬的剪切力下生長,表現出生理表型、增殖、對齊並滿足活組織滲透性。
為了模擬體內的條件,選擇灌流系統的種類是關鍵。雖然蠕動幫浦已廣泛使用且相對便宜,但它們推送有脈衝的液流,在所設定的流量數值下來回震盪。這些不穩定的震盪無法代表任何的生理條件而且會損傷細胞,相反地,氣動式壓力控制系統可以推送穩定固定的液流,或是依需求推送模擬主動脈的真實脈衝波型,壓力及流量都可以被用來監測實驗參數。此外,如果考慮降低花費,可以串聯自動切換閥與壓力控制器,培養液可以不斷地循環使用。

表1.Fluigent氣動式壓力控制器與蠕動幫浦的優勢與缺點比較
為了證明液流穩定對血管模型中的重要性,血管內皮細胞培養在微流體晶片中,然後分別用氣動式壓力控制器與蠕動幫浦進行灌流培養。
材料與方法

1.材料
| 1) | 微流體液流控制器:Flow EZ是先進的氣動式液流壓力控制器,這裡使用了兩組最大壓力1000mbar的Flow EZ | |
| (2) | 流量計:Flow Unit是即時量測微流體流量的感測器,這裡使用了一組Flow Unit M監控流量 | |
| (3) | 切換閥:L-Switch是六孔雙方向切換閥,可切換不同的液體注入,它的配置適合用來做液流循環實驗 | |
| (4) | 切換閥連接器:Switch-EZ可以與Flow EZ串聯並控制 Fluigent的切換閥,一次最多可控制六組切換閥 | |
| (5) | 微流體晶片:BeOnChip-BE-Flow是專為細胞培養設計的精巧微流體晶片,允許兩個獨立的通道中進行長時間二維或三維的培養 |
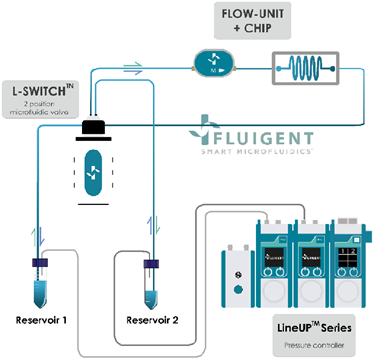
圖1.使用氣動式壓力控制器進行液流循環的工作原理。兩組Flow EZ連接至兩組15mL樣品管,樣品管管線連接到L-Switch切換閥以進行循環實驗,然後再連接到流量計Flow Unit M以及微流體晶片。使用軟體All-in-One (A-i-O)或Microfluidics Automatic Tool (MAT)進行自動化控制。
在使用蠕動幫浦的系統中,晶片進出管線皆接到裝有培養液的樣品管中,使用蠕動幫浦連續推送。
2.微流體細胞培養的步驟
為了比較兩推送系統的差異,微流體晶片BeOnChip種入內皮細胞(HBEC-5i:ATCC® CRL-3245TM),HBEC-5i 細胞使用含有10%FBS的DMEM-F12培養液培養生長,並補充40μg/mL內皮細胞生長添加劑及1%抗生素。
| (1) | 以0.1 mg/mL collagen type1於37度C下塗佈晶片通道。 | |
| (2) | 種入上述細胞懸浮液,直到形成單細胞層(48小時)。 | |
| (3) | 依照下方連結的影片指示,連接晶片與微流體系統。 | |
| (4) | 放置於37度C、5%二氧化碳環境的培養箱,設定流速50μL/min培養24小時。 |
明視野及螢光顯微鏡(Nikon Ti-E)用來觀測細胞,細胞核以Hoestch blue螢光染色,影像則用FIJI軟體進行分析。
結果與討論
1.種入細胞 (以及液流驅動)
在以膠原蛋白塗佈微流體晶片後,HBEC-I 細胞被種入於內。圖2顯示細胞在以不同的幫浦灌流前附著於晶片的情況,兩晶片都顯示細胞達到大約80% 飽和度。細胞以多角或三角形良好散佈,顯示細胞是健康的。值得注意的是,兩晶片之間無論是細胞飽和度還是細胞形狀都沒有明顯的差異,在開始流液體進入微流體晶片前,兩晶片間細胞培養表現出相似的活性與數量。

圖2.HBEC-5i細胞種入BE-Flow晶片未流液體前的顯微鏡影像。
上排:氣動式壓力控制器,灌流時間為0;
下排:蠕動幫浦,灌流時間為0。比例尺為100μm。
2.液體灌流
當細胞貼附好後,培養液分別以氣動式壓力控制器Fluigent Flow EZ及蠕動幫浦推送循環灌流,流量均設定為50μL/min持續24小時。圖3顯示了流量隨時間變化的圖,氣動式壓力控制器為藍色線;蠕動幫浦為橘色線。使用蠕動幫浦流量震盪很大,最低與最高流量分別為30μL/min及65μL/min,相較於設定的50μL/min流量,這相當於40%的變動。當強而不平衡超過40%的脈衝會導致細胞分離及細胞死亡(失去細胞膜完整性),也會對細胞功能(增殖、基因表現)產生衝擊,這是非常關鍵的因素。當使用Flow EZ時,我們觀察到流量非常穩定,最大及最小的流量差異小於2%,細胞在此穩定的流量下,與體內遇到平緩而一致的剪切力狀況相同。
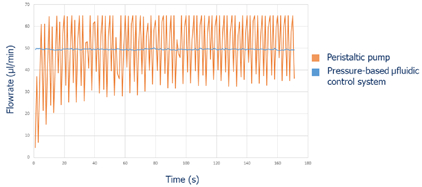
圖3.分別以氣動式壓力控制器及蠕動幫浦推送循環灌流流量隨時間變化圖,流量設定50μL/min
3.培養24小時後的細胞活性
在循環灌流培養24小時後,細胞以顯微鏡觀察如圖4。在以蠕動幫浦灌流的細胞培養,我們觀察到相較於時間為0時的細胞密度下降了,實驗初期大約有80%的飽和度,24小時後僅剩大約50%。30%細胞密度的下降意味著強大的流量震盪導致了細胞脫離,而且細胞形狀變圓意味著即使沒有脫離的細胞也變得較沒活力。這樣蠕動幫浦造成糟糕的液流狀況可能對細胞功能產生影響。
在以Flow EZ推送的細胞灌流,我們觀察到24小時大約80%的飽和度與實驗初期接近,並且細胞也有與初期相似的形狀與散佈狀況。這些結果確認了以Flow EZ進行細胞灌流培養可以因為理想的液流狀態維持細胞的健康與活性。

圖4.HBEC-5i細胞種入BE-Flow晶片灌流培養後的顯微鏡影像。
上排:氣動式壓力控制器,灌流時間為24小時;
下排:蠕動幫浦,灌流時間為24小時。比例尺為100μm。
表2 摘要了所觀測的結果,證明了相同實驗條件下,以氣動式壓力控制器灌流培養比蠕動幫浦對細胞更友善。
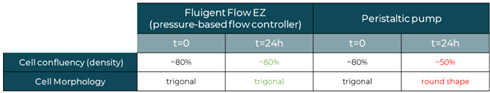
表2.兩種液流控制進行細胞灌流培養的結果摘要
結論
當從傳統細胞培養轉換到微流體細胞培養,注意力常聚焦於晶片上,但我們證明了灌流系統也如同晶片一樣重要。選擇對的設備重現細胞在體內的液流狀況是很重要的,它會影響到細胞生存、散佈、表現型與基因表現。在上述的應用實例中,僅在一天灌流培養後,血管內皮細胞在不穩定脈衝液流下持續死亡,相反地,當用相似於體內狀況提供穩定剪切力的液流下,細胞於晶片內生長的很好。
此篇應用實例主要結果摘要如下:
| 1. | 使用蠕動幫浦的流量變動達到40% |
| 2. | 使用Flow EZ的流量穩定,僅有小於2%的變動 |
| 3. | 以有脈衝液流灌流培養僅一天,下降了30%的細胞飽和度,導致細胞出現脫附、不健康,強烈影響了細胞散佈及表現型 |
| 4. | 穩定而一致的液流灌流培養促進了細胞生存,並且維持生理表現型 |


