微觀世界下的奈米紅外光譜技術源於原子力紅外顯微鏡(nanoIR)
原理與特點
原子力紅外光譜顯微鏡(AFM-IR)其原理,是利用AFM的探針檢測針尖處受到紅外雷射光源的照射,而與其接觸的樣品表面,因吸收特定波長的紅外光而導致其接觸表面產生了熱膨脹。目前商品化的儀器架構如圖1所示,其中儀器的主要組成分別為AFM測量系統(懸臂以及雷射偵測器)以及脈衝可調式紅外雷射光源。
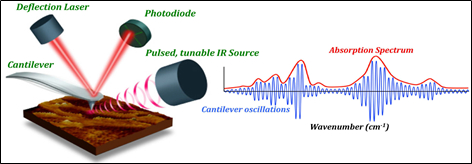
圖1.AFM-IR的儀器架構,分為AFM測量系統以及脈衝可調式紅外雷射光源
AFM-IR之所以可以通過測定懸臂力學振幅行為之變化,來獲得探針處樣品表面對特定波長紅外光的吸收情況,是因為二者之間存在一定的對應關係,可根據以下原理計算進行簡單的分析:
(1) 首先,當紅外雷射光源與樣品表面進行相互作用時,樣品表面吸收的能量,可以用坡印廷向量(P)進行表示:
.jpg)
(2) 根據傅立葉熱傳導定律,由紅外光吸收所導致的光熱效應產生的最大升溫(ΔTmax)可以表示為:
.jpg)
(3) 樣品表面的升溫導致了熱膨脹(u),其可以表示為:
.jpg)
(4) 因此,從上面所做的類比方程式推導中,我們可以得到,樣品表面的熱膨脹(u)與紅外光的吸收所造成的最大升溫(ΔTmax)成正比。
另一方面,我們希望利用AFM的懸臂探針來檢測樣品表面的熱膨脹,懸臂的運動可以用Euler-Bernoulli方程式來進行描述:
.jpg)
其中q為在探針處由熱膨脹對懸臂施加的結構荷重,EI為彎曲剛度(E為楊氏模量,I 為懸臂的截面慣量),ρ為密度,S為截面面積,γ為阻尼。可以證明,懸臂運動產生的訊號與樣品表面熱膨脹的程度滿足一定的關係。對於不同的官能團,紅外吸收的特徵波數不同,從而產生的熱膨脹變化也具有一定差異,因此我們可以透過測定AFM懸臂的運動狀態變化,來表示探針接觸的樣品表面區域的紅外吸收情況,進而分析出樣品表面的化學官能基團或成分在空間上的分佈。
應用舉例
AFM-IR技術可以用於解析具有特定紅外吸收的物質在奈米尺度上的分佈狀況。這其中包括:特定物質之間的擴散與聚集,以及物質之間的形成與反應,或者是特定化學結構在表面上的化學分佈。
◎實例一
有機金屬二酚類化合物A(圖2)被證明為與Tamoxifen(一種賀爾蒙抑制劑)類似,可以與雌激素受體結合而抑制乳腺癌細胞的增生,在乳腺癌的內分泌療法方面具有一定的前瞻性。
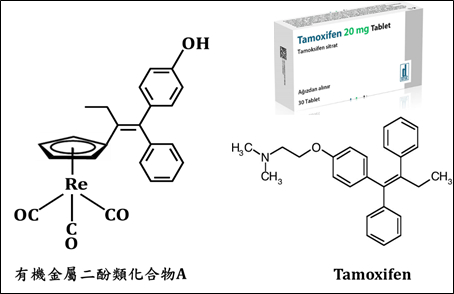
圖2.有機金屬二酚類化合物A及Tamoxifen化學分子組成構型
化合物A中金屬三羰基化合物的核心[(Cp)Re(CO)3]在2017 cm−1以及1915 cm−1具有兩個特徵的紅外吸收峰,可以用於該化合物的特性化學分布使用;同時由於核酸(以位於1240 cm−1的磷酸酯鍵吸收進行區分)以及蛋白(以位於1650 cm−1的C=O雙鍵吸收表徵(amide I band))在細胞核內的集中分佈,便可以利用AFM-IR技術確定細胞核所在的相對位置。對A物質的分佈分析表明,其更傾向於在細胞核區域發生聚集(圖3)。AFM-IR技術提供了一種非侵入式的高空間解析度的表現方法,同時避免了使用外部標記法,造成樣品干擾而失真。
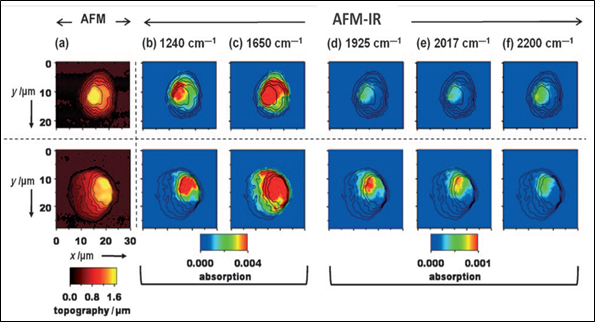
圖3.AFM-IR技術用於研究小分子A在乳腺癌細胞中的濃度分佈
◎實例二
澱粉樣蛋白的形成,在醫學研究上,被認為是神經系統退化表現的症狀之一。然而,對於蛋白聚集錯誤折疊,而形成纖維聚集體的過程,仍存在很多疑問。這種錯誤折疊伴隨著β折疊(β-sheet)結構的形成,因此對於其位於1620 cm−1(β-sheet)、1700 cm−1(反平行β-sheet以及β-strand)特徵吸收的奈米紅外光譜以及其楊氏模量的力學表現均可以說明β-sheet結構的形成過程(圖4)。對不同時間中蛋白纖維化的過程,可以很詳細表述說明出,一個全新的澱粉樣蛋白轉化機制。蛋白質單體的正常聚集以及聚集體的β-sheet轉化誘導了最終的纖維狀轉變,整個過程並不是起始於蛋白質單體Josephin區域的β-sheet轉化。這個研究,可透過AFM-IR技術,同時提供了力學(模量)以及化學結構分佈的資料證據,對於澱粉樣蛋白纖維結構的形成給出了強而有力的說明。
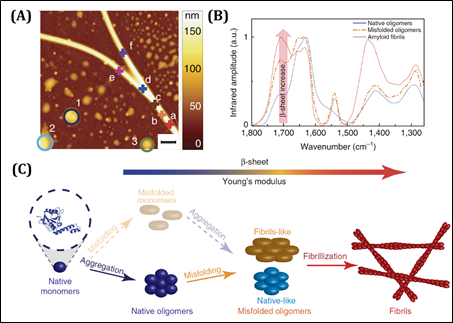
圖4.AFM-IR技術用於研究澱粉狀蛋白的形成機制。
(A)為AFM高度圖,對標記點處可以進行紅外吸收光譜分析。
(B)為蛋白聚集體幾種不同構型紅外光譜的差異。
(C)為學者們提出的澱粉狀蛋白的形成過程。
總結
透過AFM-IR技術,實行了在奈米尺度上的化學分析。其快速地發展,靈活運用於材料科學、奈米維度表面科學、生命科學等研究中,成為舉足輕重的地位。
參考資料
1. Subcellular IR Imaging of a Metal–Carbonyl Moiety Using Photothermally Induced Resonance
https://doi.org/10.1002/anie.201003161
2. Infrared nanospectroscopy characterization of oligomeric and fibrillar aggregates during amyloid formation
https://doi.org/10.1038/ncomms8831


